Test chemiczny na temat „Przegląd niemetali” (klasa 11) Pełne imię i nazwisko: Timokhina Alena WładimirownaStanowisko: nauczyciel biologii, chemiiMiejsce pracy: Miejska Instytucja Oświatowa „Szkoła Średnia Rassvetskaya” im. V. V. LapinaCelem jest odtworzenie właściwości fizycznych i chemicznych niemetali.Zadania:1. Edukacyjne – badanie właściwości i produkcji niemetali;2. Edukacyjna – rola niemetali w przyrodzie;3. Rozwojowe - porównaj właściwości niemetali. Test
- Pierwiastek chemiczny posiadający następujące izotopy: prot, deuter, tryt.
- Tlen Siarka Wodór Fosfor
- W reakcjach redoks obecny jest wodór.
- Silny środek utleniający Neutralny Utleniacz, środek redukujący Silny środek redukujący
- Stan utlenienia wodoru związkami metali.
- +1
– 1
– 2
+2
- Kontynuuj zdanie: „Kiedy zapali się mieszanina 2 objętości wodoru z 1 objętością tlenu, połączenie gazów następuje natychmiast i towarzyszy temu silny wybuch”. Zapisz równania reakcji po łańcuchu.
- Nazwij pierwiastek chemiczny odpowiadający następującemu stwierdzeniu: „Typowy niemetal, który nie ma właściwości redukujących”.
- Tlen Chlor Fluor Siarka
- Wybierz wspólne właściwości charakterystyczne dla halogenów?
- Przeważnie mają stopień utlenienia 1 Interakcja z prostymi substancjami Wszystkie wykazują właściwości utleniające i redukujące Do halogenów należą: F 2
,
kl 2
,
I 2
,
br 2
,
Na
- Podaj nazwę pierwiastka chemicznego, który ma następujące właściwości fizyczne: bezbarwny, bezwonny gaz, cięższy od powietrza.
- Tlen Wodór Azot Węgiel
- Napisz równanie reakcji, która służy do produkcji tlenu w laboratorium. Wybierz właściwość fizyczną, któraNie
odpowiada Serze.
- Kruche żółte kryształy Rozpuszczalny w wodzie Ma modyfikacje alotropowe: rombowe, plastikowe Dobrze rozpuszcza się w dwusiarczku węgla i benzenie
- Pierwiastek chemiczny posiadający następujące modyfikacje alotropowe: diament, grafit, węgiel.
- Siarka Węgiel Fosfor Selen
- Dopasuj reakcje połówkowe jonów do równań reakcji w procesie utleniania i redukcji.
A) S +6 +2e = S +4
- Uzupełnij równania reakcji (zapisz bilans OM dla reakcji redoks).

- Rozwiąż zadanie: Tlen otrzymano z 7,9 g nadmanganianu potasu, który przereagował z magnezem. Jaka masa tlenku magnezu zostanie otrzymana? Rozwiąż zadanie: Kiedy 14,2 g chloru reaguje z 1 g wodoru, otrzymuje się chlorowodór HCl
Odpowiedzi do zadań testowych
1.
V2.
G3.
B4.
Wybuchowy gaz5.
2
H 2
+
O 2
= 2
H 2
O 2H 2 O + CaH 2 = 2H 2 + Ca (OH) 2 H 2 + CuO = H 2 O + Cu 6.
V7.
ok8.
A9.
10.
B11.
B12.
A -1,4; B – 1; W 2; G – 3.13.a)
B)
V)
G)
D)
mi)
I)
14.
Tlen otrzymano z 7,9 g nadmanganianu potasu, który przereagował z magnezem. Jaka masa tlenku magnezu zostanie otrzymana? 
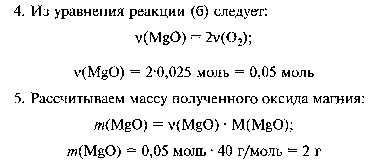 15.
Gdy 14,2 g chloru reaguje z 1 g wodoru, otrzymuje się chlorowodór HCl . Wyznaczyć: a) masę otrzymanego chlorowodoru; b) jaki gaz pozostanie w nadmiarze i masa tego nadmiaru.
15.
Gdy 14,2 g chloru reaguje z 1 g wodoru, otrzymuje się chlorowodór HCl . Wyznaczyć: a) masę otrzymanego chlorowodoru; b) jaki gaz pozostanie w nadmiarze i masa tego nadmiaru.


Bibliografia
- Rudzitis G. E. Chemia. Podstawy chemii ogólnej. Klasa 11: edukacyjna. dla edukacji ogólnej instytucje / G. E. Rudzitis, F. G. Feldman. – wyd. 14. – M.: Edukacja, 2011. – 159 s. Lidia R.A. Właściwości chemiczne substancji nieorganicznych: Podręcznik. podręcznik dla uniwersytetów. Wydanie 3, poprawione/R.A. Lidin, VA Mołoczko, L.L. Andreeva; wyd. RA Lidyna. - M.: Chemia, 2000. 480 s.: N. L. Glinka. chemia ogólna Khomchenko I. G. Zbiór problemów i ćwiczeń z chemii dla szkoły średniej. – wyd. 2, poprawione. i dodatkowe – M.: RIA „Nowa Fala”: Wydawnictwo Umerenkov, 2011. – 214 s.
W testach jest tylko 26 pytań. Podawane jest pytanie i prawidłowa odpowiedź.
Testy do programu szkolnego z chemii
|
Płynny metal? (Rtęć) |
||
|
Jak nazywają się substancje składające się z atomów tego samego typu? (Prosty) |
||
|
Kolor fenoloftaleiny w zasadach? (Karmazynowy) |
||
|
Gaz spalinowy? (Tlen) |
||
|
Jak nazywa się najmniejsza cząsteczka substancji, która określa jej właściwości? (Cząsteczka) |
||
|
Objętość jednego mola gazu? (22,4 l) |
||
|
Kto odkrył prawo zachowania masy substancji? (Łomonosow) |
||
|
Gaz używany do cięcia i spawania metali? (Tlen) |
||
|
Najmniejsza niepodzielna cząstka pierwiastków? (Atom) |
||
|
Jaki jest najliczniejszy pierwiastek na Ziemi? (Tlen) |
||
|
Jak nazywają się sole kwasu siarkowego? (Siarcany) |
||
|
Kto odkrył prawo okresowości? (Mendelejew) |
||
|
Jakiego gazu jest najwięcej w atmosferze ziemskiej? (Azot) |
||
|
Który kwas jest bardziej słony, kwas siarkowy czy kwas węglowy? (Siarkowy) |
||
|
Skład cząsteczki wody (wzór wody)? (H2O) |
||
|
Jaka jest wartościowość tlenu? (2) |
||
|
Formuła kwasu azotowego? ( HNO-3) |
||
|
Najlżejszy gaz? (Wodór) |
||
|
Jak nazywa się liczba zapisana przed wzorami? (Współczynnik) |
||
|
Określ kwas bezkwasowy: siarkowy, solny, azotowy. (Sól) |
||
|
Substancje zmieniające szybkość reakcji chemicznych? (katalizatory) |
||
|
Ile stanów skupienia ma woda? (Trzy) |
||
|
Jednostka miary ilości substancji? (Kret) |
||
|
W jakiej temperaturze wrze czysta woda? (100) |
||
|
Gaz potrzebny do oddychania? (Tlen) |
||
|
Formuła tlenu? (O-2) |
Test z chemii
I. Poznaj istotę prawa okresowości D. I. Mendelejewa w świetle teorii budowy atomu.
1.Wskazać nazwę pierwiastka tworzącego związki amfoteryczne:
c) sód.
2. Wyznacz element będący częścią głównej podgrupy:
a) wapń,
b) żelazo,
3. Wyznacz liczbę elektronów, która może zawierać się w podpoziomie f powłoki elektronowej:
4. Ustal zgodność między liczbą elektronów na poziomie energii zewnętrznej a nazwą pierwiastka chemicznego:
a) 1, 1. potas,
b) 2, 2. chlor,
c) 3, 3. fosfor,
d) 5. 4. aluminium,
5. Ustal sekwencję rosnącego ładunku jądra pierwiastków:
b) sód,
c) rubid,
d) ukwiał.
6. Połącz symbol elementu z jego nazwą:
a)Al, 1.magnez,
b) Na, 2. azot (azot),
c) N, 3. rtęć,
d) Hg. 4. aluminium,
5. sód.
7. Wskaż pierwiastki, które mogą wykazywać wartościowość II:
a) sód,
b) wapń,
c) aluminium.
d) magnez,
d) bagry,
d) żelazo.
8. Oznacz element drugiej grupy:
b) węgiel (węgiel),
c) aluminium,
9. Określ masę cząsteczkową związku CaCo3:
10. Wybierz cechę składu cząsteczki prostej substancji:
a) składa się z atomów tego samego typu,
b) składa się z atomów różnego typu,
c) zawiera tylko dwa atomy.
d) zawiera tylko jeden atom.
11. Wskaż liczbę protonów w jądrze atomu o numerze 20:
II Metan. Opisać budowę cząsteczek, właściwości i zastosowania.
1. Wyznacz wartościowość węgla w związkach organicznych:
o czwartej,
2. Wyznacz różnicę homologiczną w szeregu homologicznym alkanów:
3. Podaj wzór cząsteczkowy metanu:
4. Wskaż możliwe produkty spalania metanu:
a) tlen,
c) dwutlenek węgla,
5. Wskaż właściwości charakterystyczne metanu:
a) gazowy,
b) płyn,
c) zagrożenie wybuchem,
d) lżejszy od powietrza,
e) dobra rozpuszczalność w wodzie.
6. Wskaż możliwe produkty rozkładu metanu:
a) wodór molekularny,
b) wodór atomowy,
7. Charakterystyczna reakcja metanu to:
a) podstawienia,
b) przystąpienie,
c) wymiana.
d) polimeryzacja.
8. Zgodnie ze strukturą molekularną metan to:
a) alkin,
b) alken,
c) alkan,
d) cyklany.
9. Wskaż ogólny wzór cząsteczkowy homologicznej serii alkanów:
b) Сu H2n – 2bb
d) Сu H2n – 4.
10. Podpisz związki, z którymi reaguje metan:
11. Metan wykorzystywany jest jako surowiec w procesach:
a) utlenianie,
b) przywrócenie,
c) polimeryzacja,
d) synteza nowych substancji,
Opcja 1
1. Trzy warstwy elektronowe i dwa elektrony na zewnętrznym poziomie elektronicznym odpowiadają elementowi:
2.
3. X ich promień atomowy:
4. Substancja posiadająca spolaryzowane wiązanie kowalencyjne to:
1) Cl 2 2) NaBr 3) H 2 S 4) CaCl 2
5. Wiązanie chemiczne odpowiednio w chlorku sodu, azocie i metanie:
6 . Niemetaliczne właściwości pierwiastków w okresie ze wzrostem ładunku jądrowego atomów:
1) zintensyfikować 2) zmieniać się okresowo
osłabić 4) nie zmieniać się
7. Najmniej Stopień utlenienia chromu w związku jest następujący:
1) K 2 CrO 4 2) CrSO 4 3) CrO 3 4) Cr 2 (SO 4) 3
8.
III) 4) tlenek węgla( II)
9.
1) ortoklaz
3) topaz Al 2 4) kaolinAl 2
10. 0,4 mol siarczanu cynku zawiera:
1) 2,408
11. Masa 3 moli tlenku węgla (IV):
1) 44 g 2) 132 g 3) 1,32 g 4) 22,4 g
12. Ilość substancji odpowiadająca 4,48 litra amoniaku:
1.
1) tlenek węgla (II) A) jonowy
2) ozon B) kowalencyjny niepolarny
3) wodorotlenek amonu B) kowalencyjny polarny
4) bromek magnezu D) metal
6) kryształ wody E) donor-akceptor
7) chlorowodór
2.
1) Jonowy A) tlenek węgla (IV) B) grafit
2) Molekularny C) siarczek miedzi(I) D) cyna
3) Atomowa D) woda E) krystaliczna siarka
4) Metal G) chlorek magnezu H) chlorowodór
Zadania testowe dla uczniów chemii w klasie 11 według programu podstawowego
„Skład, struktura i właściwości substancji”.
Opcja nr 2
I. Znajdź tylko jedną poprawną odpowiedź na podane stwierdzenie.
1. Elementowi odpowiadają dwie warstwy elektronowe i trzy elektrony na zewnętrznym poziomie elektronowym:
2.
DI. Mendelejew odpowiada:
1) liczba elektronów w atomie; 2) liczba elektronów na ostatnim poziomie;
3) liczbę brakujących elektronów do uzupełnienia poziomu elektronicznego;
4) liczba poziomów elektronowych w atomie.
3. X pierwiastki chemiczne ułożone są w porządku malejącymich promień atomowy:
4.
1) Cl 2 2) NaBr 3) H 2 S 4) CaCl 2
5. Wiązanie chemiczne odpowiednio w chlorowodorze, tlenku baru i ozonie:
kowalencyjne niepolarne, jonowe i kowalencyjne polarne
jonowe, kowalencyjne niepolarne i kowalencyjne polarne
kowalencyjne polarne, jonowe i kowalencyjne niepolarne
jonowe, kowalencyjne polarne i kowalencyjne niepolarne
6. Właściwości metaliczne pierwiastków w grupie o rosnącym ładunku jądrowym atomów:
1) zintensyfikować 2) zmieniać się okresowo
3) osłabić 4) nie zmieniać się
7. Najmniej Stopień utlenienia manganu w związku jest następujący:
1) K 2 MnO 4 2) MnSO 4 3) MnO 3 4) Mn 2 (SO 4) 3
8. Jonowa sieć krystaliczna ma:
1) chlor 2) chlorek cezu 3) chlorek fosforu ( III) 4) tlenek węgla( II)
9. Do produkcji aluminium bardziej opłaca się stosować:
1) ortoklaz K, 2) anortyt Ca,
3) topaz Al 2 (FOH) 2 4) kaolinAl 2
10. 2 mole siarczanu cynku zawierają:
1) 2,408 10 23 cząsteczki 2) 24,08 10 23 cząsteczki 3) 12,04 10 23 cząsteczki 4) 3,01 10 23 cząsteczki
11 . Masa 0,5 mola tlenku węgla (IV):
1) 44 g 2) 132 g 3) 1,32 g 4) 22 g
12. Ilość substancji odpowiadająca 44,8 litrom amoniaku:
1) 17 g 2) 22,4 l/mol 3) 2 mol 4) 0,2 mol
I I. Znajdź odpowiednią poprawną odpowiedź na zaproponowaną koncepcję
(Cyfry i litery wOdpowiedź można powtórzyć.)
1. Dopasuj nazwę substancji do rodzaju wiązania chemicznego, dzięki któremu jest ona utworzona:
2) gazowy tlen B) kowalencyjny niepolarny
3) chlorek amonu B) jonowy
5) sód metaliczny D) wodór
6) alkohol etylowy E) donor-akceptor
7) chlorek baru
2 . Dopasuj nazwę sieci krystalicznej do odpowiednich substancji:
1) Jonowy A) tlenek ołowiu (IV) B) diament
2) Molekularny C) tlenek miedzi(I) D) cyna
3) Atomowy D) lód E) krystaliczny fosfor
4) Metal G) jodek magnezu H) bromowodór
Zadania testowe dla uczniów chemii w klasie 11 według programu podstawowego
„Skład, struktura i właściwości substancji”.
Opcja nr 3
I. Znajdź tylko jedną poprawną odpowiedź na podane stwierdzenie.
1. Elementowi odpowiadają trzy warstwy elektronowe i sześć elektronów na zewnętrznym poziomie elektronowym:
1) krzem; 2) magnez; 3) siarka; 4) tlen
2. Numer grupy pierwiastka chemicznego w układzie okresowym
DI. Mendelejew odpowiada:
1) liczba elektronów w atomie; 2) najwyższy stopień utlenienia;
3) liczbę brakujących elektronów do uzupełnienia poziomu elektronicznego;
4) liczba poziomów elektronowych w atomie.
3. X pierwiastki chemiczne ułożone są w kolejności rosnącejich właściwości metaliczne:
1) Li, Be, B, C 2) P, S, Cl, Ar 3) Sb, As, P, N 4) F, Cl, Br, I
4. Substancja posiadająca jonowe wiązanie chemiczne to:
1) Cl 2 2) H Br 3) H 2 S 4) CaCl 2
5 . Wiązanie chemiczne odpowiednio w ozonie, metanie i chlorku sodu:
kowalencyjne niepolarne, kowalencyjne polarne i jonowe
jonowe, kowalencyjne niepolarne i kowalencyjne polarne
kowalencyjne polarne, jonowe i kowalencyjne niepolarne
jonowe, kowalencyjne polarne i kowalencyjne niepolarne
6. Promień atomowy pierwiastków w okresie ze wzrostem ładunku jądrowego atomów:
1) wzrasta 2) zmieniać się okresowo
3) maleje 4) nie zmienia się
7. Najmniej Stopień utlenienia chloru w związku wynosi:
1) KCLO 4 2) CaCL 2 3) CL 2 4) HCLO 3
8. Jonowa sieć krystaliczna ma:
1) chlorek ceru 2) chlor 3) chlorek fosforu ( III) 4) tlenek węgla( II)
9. Do produkcji aluminium bardziej opłaca się stosować:
1) ortoklaz K, 2) kaolinAL 2 (OH) 4
3) zapalenie odbytu Ca, 4) topaz AL 2 (FOH) 2
10. 2,5 mola siarczanu cynku zawiera:
1) 15,05 10 23 cząsteczki 2) 24,08 10 23 cząsteczki 3) 6,02 10 23 cząsteczki 4) 3,01 10 23 cząsteczki
11. Masa 0,5 mola tlenku siarki (VI):
1) 40 g 2) 132 g 3) 80 g 4) 22,4 g
12. Ilość substancji odpowiadająca 2,24 litra wody parowej:
1) 17 g 2) 22,4 l/mol 3) 2 mol 4) 0,1 mol
I I. Znajdź odpowiednią poprawną odpowiedź na zaproponowaną koncepcję
(Cyfry i litery mogą się powtarzać w odpowiedzi.)
1. Dopasuj nazwę substancji do rodzaju wiązania chemicznego, dzięki któremu jest ona utworzona:
1) tlenek miedzi(II) A) jonowy
2) chlor B) kowalencyjny niepolarny
3) kryształ wody B) kowalencyjny polarny
4) bromowodór D) metal
5) cynk metaliczny D) wodór
6) wodorotlenek amonu E) donor-akceptor
7) chlorek srebra
2. Dopasuj nazwę sieci krystalicznej do odpowiednich substancji:
1) Jonowy A) tlenek węgla (IV) B) cyna
2) Metaliczny B) siarczek miedzi(I) D) siarka krystaliczna
3) Atomowy D) woda E) grafit
4) Molekularny G) chlorek magnezu H) fluorowodór
Zadania testowe dla uczniów chemii w klasie 11 według programu podstawowego
„Skład, struktura i właściwości substancji”.
Opcja nr 4
I. Znajdź tylko jedną poprawną odpowiedź na podane stwierdzenie.
1. Elementowi odpowiadają trzy warstwy elektronowe i cztery elektrony na zewnętrznym poziomie elektronowym:
1) krzem; 2) magnez; 3) bor; 4) tlen
2. Numer okresu pierwiastka chemicznego w układzie okresowym
DI. Mendelejew odpowiada:
1) liczba elektronów w atomie; 2) liczba warstw elektronowych w atomie;
3) liczbę brakujących elektronów do uzupełnienia poziomu elektronicznego;
4) liczba elektronów na ostatnim poziomie
3. X pierwiastki chemiczne ułożone są według osłabieniaich właściwości metaliczne:
1) Li, Be, B, C 2) Ar, S, P, Cl 3) P, As, Sb, N 4) F, Cl, Br, I
4 . Substancja posiadająca kowalencyjne wiązanie niepolarne to:
1) H 2 O 2) O 2 3) Br 2 O 7 4) CaO
5. Wiązanie chemiczne odpowiednio w chlorku magnezu, azocie i tlenku fosforu (V):
kowalencyjne niepolarne, jonowe i kowalencyjne polarne
jonowe, kowalencyjne niepolarne i kowalencyjne polarne
kowalencyjne polarne, jonowe i kowalencyjne niepolarne
jonowe, kowalencyjne polarne i kowalencyjne niepolarne
6. Promień atomowy pierwiastków w grupie o rosnącym ładunku jądrowym atomów:
1) nie zmieniać 2) zmieniać się okresowo
3) wzrost 4) spadek
7. Najmniej Stopień utlenienia siarki w związku to:
1) K 2 SO 4 2) MnSO 3 3) SO 3 4) H 2 S
8. Molekularna sieć krystaliczna ma:
1) chlorek glinu ( III) 2) chlorek cezu 3) tlenek cynku ( II) 4) chlor gazowy
9 . Do produkcji aluminium bardziej opłaca się stosować:
1) kaolini Al 2 2) ortoklaz K,
3) topaz Al 2 4) anortyt Ca,
10. 4 mole siarczku glinu zawierają:
1) 2,408 10 23 cząsteczki 2) 24,08 10 23 cząsteczki 3) 24,08 10 21 cząsteczki 4) 3,01 10 23 cząsteczki
11. Masa 1,5 mola tlenku azotu (V):
1) 44 g 2) 162 g 3) 1,32 g 4) 22 g
12. Ilość substancji odpowiadająca 11,2 litrom chlorowodoru:
1) 17 g 2) 22,4 l/mol 3) 2 mol 4) 0,5 mol
I I. Znajdź odpowiednią poprawną odpowiedź na zaproponowaną koncepcję
(Cyfry i litery wOdpowiedź można powtórzyć.)
1. Dopasuj nazwę substancji do rodzaju wiązania chemicznego, dzięki któremu jest ona utworzona:
1) tlenek żelaza (II) A) kowalencyjny polarny
2) metaliczny sód B) kowalencyjny niepolarny
3) chlorek amonu B) wodór
4) bromowodór D) metal
5) alkohol etylowy D) jonowy
6) gazowy tlen E) donor-akceptor
7) chlorek baru
2. Dopasuj nazwę sieci krystalicznej do odpowiednich substancji:
1) Atom A) lód B) jodek magnezu
2) Molekularny C) tlenek miedzi(I) D) tlenek ołowiu(IV).
3) Jonowy D) cyna E) krystaliczny fosfor
4) Metal G) diament H) bromowodór
Klucze do testowania zadań
Opcja 1
Część 1
№?
1
2
3
4
5
6
7
8
9
10
11
12
odpowiedź
2
2
4
3
2
1
2
2
2
1
2
4
Część 2
№?
1
2
Numer
1
2
3
4
5
6
7
1
2
3
4
Listy
V
B
mi
A
G
D
V
c, gł
a, d, godz
B,
G
Opcja nr 2
Część 1
№?
1
2
3
4
5
6
7
8
9
10
11
12
odpowiedź
3
2
1
1
3
1
2
2
2
3
4
3
Część 2
№?
1
2
Numer
1
2
3
4
5
6
7
1
2
3
4
Listy
V
B
mi
A
G
D
V
a, c, g
d, godz
b, f
G
Opcja nr 3
Część 1
№?
1
2
3
4
5
6
7
8
9
10
11
12
odpowiedź
3
2
4
4
1
3
2
1
3
1
1
4
Część 2
№?
1
2
Numer
1
2
3
4
5
6
7
1
2
3
4
Listy
A
B
D
V
G
mi
A
c, f,
B
g, f
d, h, a
Opcja nr 4
Część 1
№?
1
2
3
4
5
6
7
8
9
10
11
12
odpowiedź
1
2
1
2
2
3
4
4
4
2
2
4
Część 2
№?
1
2
Numer
1
2
3
4
5
6
7
1
2
3
4
Listy
D
G
mi
A
V
B
D
g, f
a, godz
pne,
D
Opracowano zadania testowe
nauczyciel chemii MBOU Liceum nr 27 w Chabarowsku
Demina Tatiana Wiaczesławowna
Zadania testowe z chemii (opracowane przez Marina Pavlovna Ivanova)
1.Zasada sprzeczności.
1) Jądro - jest integralną częścią atomu: a) z elektronami; b) bez elektronów.
2) Przy niewielkim wzroście ciśnienia rozpuszczalność gazów w wodzie:
a) wzrasta; b) nie wzrasta.
3. Zmiana ciśnienia na stan równowagi chemicznej w układzie N2+O2=2NO:
a) wpłynie; b) nie będzie mieć wpływu
2. Zasada sprzeciwu.
1. Stopień utlenienia pierwiastka podczas utleniania: 1) wzrasta; 2) maleje.
2. Przy niewielkim wzroście ciśnienia rozpuszczalność gazów w wodzie: a) wzrasta b) maleje
3. Elektrony w atomie znajdują się: a) wewnątrz jądra
b) na zewnątrz rdzenia
3. Zasada jednorodności.
1. Jądra izotopowe mają różne liczby:
a) protony b) neutrony
2. Saletra amonowa – nawóz:
a) kwaśny b) zasadowy
3. Którego gazu jest najwięcej w atmosferze ziemskiej:
a) azot b) tlen c) wodór
4. Zasada kumulacji.
1. Podczas jodometrii określa się zawartość:
a) utleniacze
b) utleniacze i reduktory
c) utleniacze, reduktory i kwasy.
2. Pojemność cieplna reakcji może wynosić:
a) pozytywne
b) negatywny
c) pozytywne i negatywne
3. Jakie właściwości wykazuje jon jodkowy w ORR:
a) tylko środek utleniający b) tylko środek redukujący
b) ani utleniacz, ani reduktor. d) zarówno utleniacz, jak i reduktor
5. Zasada kombinacji.
1. Które z tych cząstek tworzą jądra atomów?
a) neutrony i elektrony c) neutrony i protony
b) protony i elektrony d) neutrony, protony i elektrony
2. Wodne roztwory elektrolitów przewodzą prąd elektryczny dzięki:
a) kationy i elektrony c) tylko elektrony
b) aniony i elektrony d) kationy i aniony
3. Atomy, których pierwiastki zawierają 2 neutrony:
A) prot i tryt. c) hel i tryt
B) prot i hel d) prot, hel i tryt
6. Zasada gradacji.
1. W szeregu pierwiastków chemicznych C-AL-Ca liczba warstw elektronowych w ich atomach wynosi:
a) wzrasta z 3 do 5
b) wzrasta z 2 do 4
c) zmniejsza się z 4 do 2
d) zmniejsza się z 5 do 3
2. Jaki jest stopień utlenienia cynku w jonie cynkowym ZnO2:
A) +4, b) +3, c) +2, d) +1.
3. Procesowi redukcji siarki odpowiada przemiana:
A) 0…-2 b) 0…+4 c) +4…+6 d) -2…+4
7. Zasada podwójnej opozycji.
1. W szeregu tlenków N2O5 - SiO2 - BeO - CaO następuje zmiana właściwości:
a) od kwaśnego do zasadowego c) od zasadowego do amfoterycznego
b) od zasadowego do kwaśnego d) od kwaśnego do amfoterycznego
2. Substancje, których wzory RbF, HF, F2 tworzą odpowiednio wiązania chemiczne:
a) kowalencyjny niepolarny, kowalencyjny polarny, jonowy
b) jonowy, kowalencyjny niepolarny, kowalencyjny polarny
c) jonowy, niepolarny kowalencyjny, polarny kowalencyjny
d) jonowy, polarny, kowalencyjny, kowalencyjny niepolarny
3. Spalanie amoniaku to reakcja:
1) katalityczny, endotermiczny
2) katalityczny, egzotermiczny
3) niekatalityczny, egzotermiczny
4) niekatalityczny, endotermiczny
8. Zasada faset.
1. kwas solny a) zob
kwas azotowy) nie należy do grupy kwasów rozpuszczalnych b)
Kwas Siarkowy
2. Zn, Cu, Sn) należą do podgrupy wtórnej a)
b) nie mają zastosowania
Azot) substancje o strukturze molekularnej a) obejmują
Wodór b) nie stosuje się
9. Zasada implikacji.
1. Nadmierne stosowanie nawozów azotowych zwiększa zawartość:
a) fosforany b) węglany
b) siarczany d) azotany
2. Jeżeli w wyniku reakcji 2 substancji złożonych powstają dwie substancje złożone, to rodzaj reakcji:
a) substytucja c) przystąpienie
b) wymiana d) rozkład
3. Gdy ciśnienie w układzie N2+O2 = 2NO wzrasta, równowaga chemiczna:
A) przesunie się w lewo
B) przesunie się w prawo
B) nie ulegnie zmianie
10. Zasada formułowania.
1. Pierwiastek chemiczny to:
a) cząstka niepodzielna
b) zbiór atomów tego samego typu
c) rodzaj atomów
2. Tlenki to:
a) substancje złożone
b) substancje składające się z atomów metalu i tlenu
c) substancje składające się z atomów niemetalu i tlenu
d) substancje składające się z 2 różnych atomów, z których jednym jest tlen.
3. Prostą substancją jest:
A) forma istnienia pierwiastka chemicznego
B) substancje, których ilość jest większa niż pierwiastków chemicznych
B) substancja składająca się z atomów tego samego typu
11. Połączenie zasad.
1. 1. tlen ma sieć krystaliczną: a) atomową
( 2. grafit) b) jonowy
3. aluminium c) metal
d) molekularny
2. 1. CaCL2 a) kowalencyjny polarny
2. H2O) ma wiązanie: b) jonowe
3. AL c) metal
d) kowalencyjny niepolarny
3. Ar a) Elementy S
( Te ) odnoszą się do: b) elementów P



